RESEARCH
- HOME
- RESEARCH
心筋細胞の脱分化・増殖制御機構の研究
哺乳類と異なりイモリや魚などの動物は、傷ついた心筋を生理的に再生します。私たちは、高い再生能を持つゼブラフィッシュの心臓では、損傷後に心筋細胞が一時的に分化状態をさかのぼり、脱分化と言われる状態を経て増殖し、新たな心筋を作り出すことを明らかにしました。また、この過程を制御する分泌因子や免疫細胞の同定にも取り組んでいます。しかし、未だ多くの疑問が存在しています。心臓に損傷を与えると脱分化が誘導されますが、この時に心筋細胞はどんなシグナルを受け、細胞内では何が起きているのか。拍動している心臓で心筋細胞はどのように分裂し、周囲の細胞はどのように関与するのか。また、ちょうど失われた心筋に相当する分だけ新たな心筋が再生しますが、この適切な再生レベルを調節する仕組みは何か。心臓再生制御部ではゼブラフィッシュやマウスなどを用いてこのような疑問の解決に取組み、心筋細胞増殖を自在にコントロールする技術の基盤形成を目指しています。
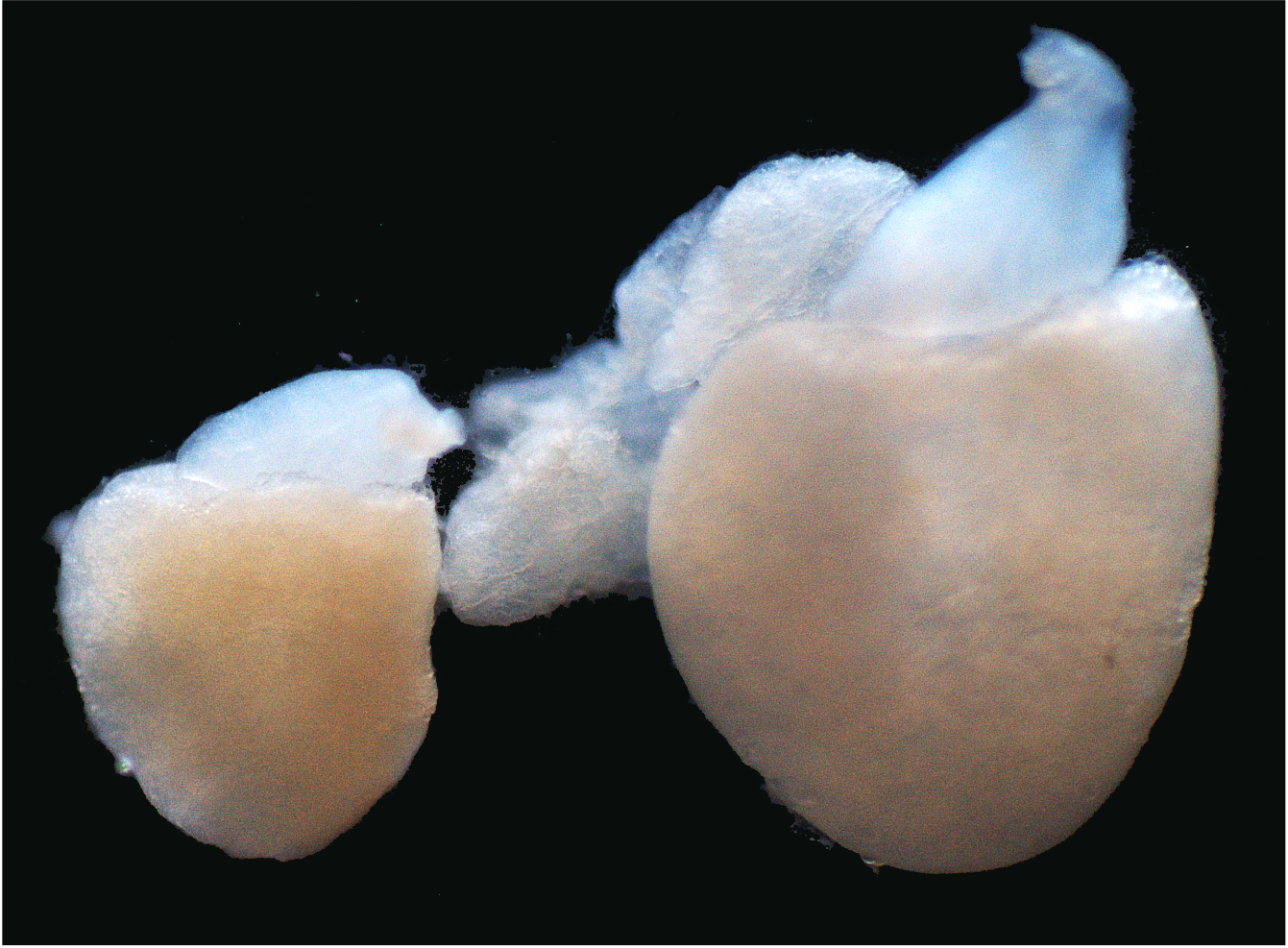
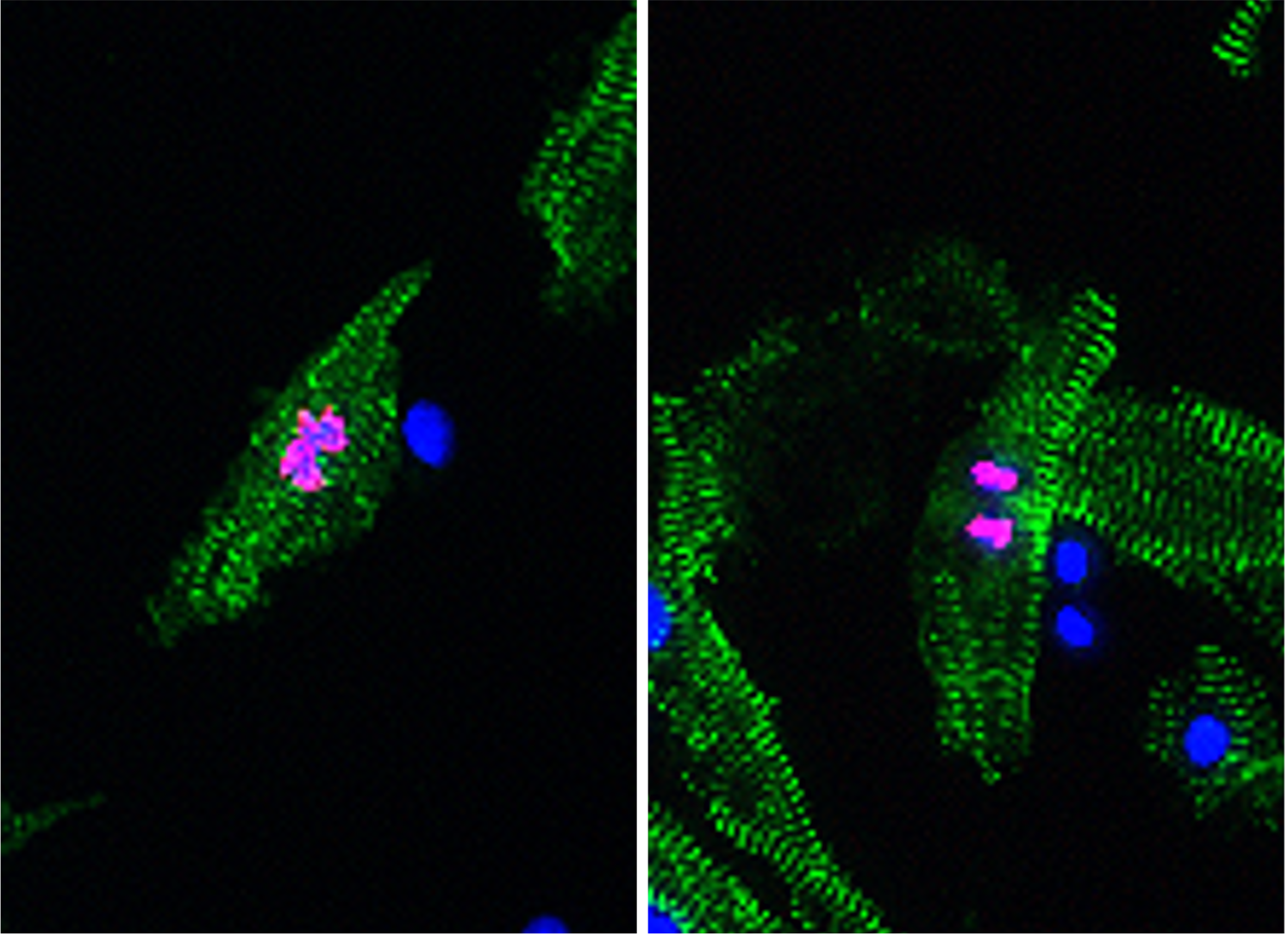

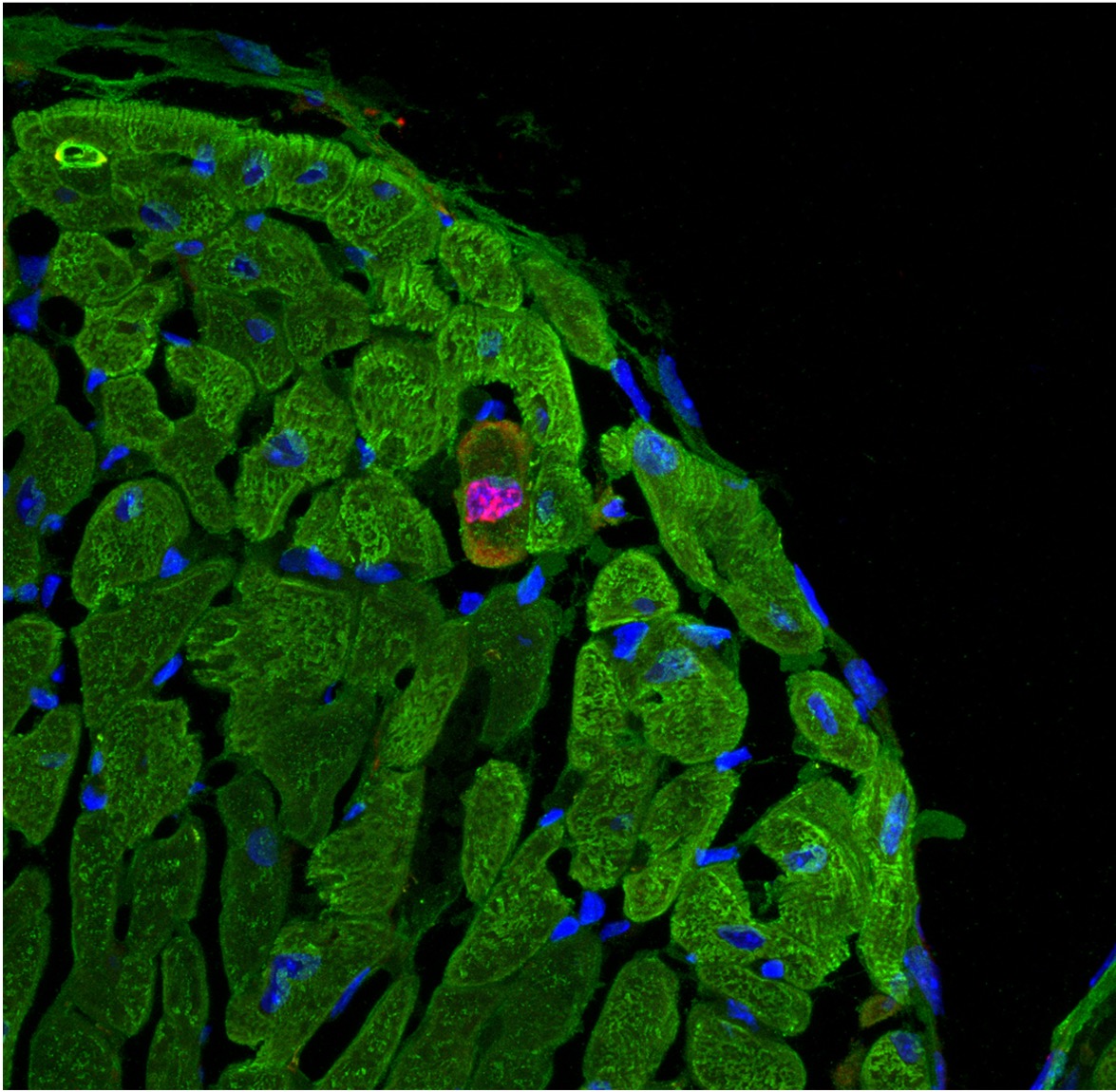
心筋の自己再生を促進する新規治療法の開発
心臓のポンプ機能は生命維持に必須です。そのポンプ機能の要となる細胞が心筋細胞ですが、上述したように哺乳類では心筋細胞がほとんど増殖しません。その結果、心筋梗塞や様々な原因で心筋細胞が失われると心機能は著しく低下し、その後の回復はきわめて困難です。しかし、最近の研究から、マウス、ラット、ブタなどの哺乳類も、生後数日の間はゼブラフィッシュなどと同様に、心筋細胞の増殖を介して心筋を再生することが分かっています。さらに、成人のヒトの心臓においても、きわめて少ない割合ながら、心筋細胞が増殖することが示唆されており、この仕組みに介入する新たな治療法の開発が期待されています。私たちは、ゼブラフィッシュの研究から、心筋細胞において脱分化・増殖の「スイッチ」を入れる遺伝子として、転写因子Kruppel-like factor 1(Klf1)を同定しました。心臓再生制御部では、この新規Klf1経路に着目し、残存する自己の心筋から新たな心筋の再生を促進する、新規核酸医薬の開発に取り組んでいます。また、開発する核酸医薬の心筋への送達や心筋細胞内での発現上昇を促進する新規技術の開発も進めています。
透明魚を用いた生体機能のイメージング研究
近年シグナル伝達や代謝変化など、重要な細胞内の反応を生きたまま観察できる技術が開発されています。しかし、個体レベルでは、循環器を含む生体内の深部組織を長期間、非侵襲的に観察することは未だ困難です。そこで、私たちは、一生を通じて全身が透明であり、ほぼ全ての臓器を生きたまま観察することができる、新規小型魚類Danionella(ダニオネラ)に注目しています。私たちが簡単に「透明魚」と呼ぶこの魚は、新種として発見されたのは40年近く前になりますが、わずか数年前から研究利用が始まったばかりの新しい動物モデルです。成体のサイズが約1.5 cmほどの世界最小の淡水魚であり、体を覆う膜や体内組織もほぼ完全に透明なため、深部組織や臓器連環のイメージングに適した画期的なモデル動物です。国立循環器病研究センター研究所では、透明魚専用の大規模飼育施設を整備し、様々な最先端顕微鏡も使用できます。心臓再生制御部では、透明魚胚を用いてゲノム編集や遺伝子導入を行い、様々な病態モデル透明魚やレポーター透明魚を作製するとともに、それらを用いた生体イメージング研究などに取り組んでいます。
